
|
|
|||||||
| Новости | Мероприятия | Персоны | Партнеры | Ссылки | Авторы | |||
| Дискуссии | Гранты и конкурсы | Опросы | Справка | Форум | Участники | |||
Все права защищены и охраняются законом.
Портал поддерживается .
При полном или частичном использовании материалов гиперссылка на http://ipim.ru обязательна!
Все замечания и пожелания по работе портала, а также предложения о сотрудничестве направляйте на info@ipim.ru.
© Интернет-портал интеллектуальной молодёжи, 2005-2025.
![]()
|
|
« вернуться к списку |
Смерть не разлучит их
01 июля 2016 00:17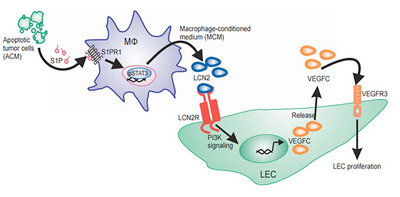
Иллюстрация с сайта www.lenta.ru Даже погибая, опухолевые клетки могут способствовать образованию метастазов. Это им удается благодаря умению управлять иммунной системой, содействуя росту новых лимфатических сосудов. Последние служат своеобразными магистралями, по которым злокачественные клетки распространяются по всему организму. "Лента.ру" ознакомилась с исследованием, которое раскрывает механизмы, лежащие в основе таких манипуляций.
Ученые из Франкфуртского университета имени Иоганна Вольфганга Гёте (Германия) и Университета Коста-Рики продемонстрировали, как происходит взаимодействие между злокачественными клетками и иммунными клетками, называемыми макрофагами. Результаты своей работы они опубликовали в журнале Science Signaling. Они показали, что когда раковые клетки умирают, они выпускают специфическую молекулу сфингозин-1-фосфат (S1P). Это сигнальный липид, который заставляет макрофаги выделять белок липокалин-2 (LCN2).
Биохимики исследовали влияние LCN2 на культуру эмбриональных стволовых клеток мышей. Было продемонстрировано, что белок увеличивает концентрацию молекул PECAM-1, которые являются индикаторами ангиогенеза и пролиферации клеток эндотелия, а также молекул LYVE-1, способствующих развитию лимфатических сосудов. Для этого исследователи приготовили среды с живыми и апоптическими опухолевыми клетками. В них поместили культуры макрофагов, которые в сочетании с мертвыми раковыми клетками синтезировали LCN2.
Исследования культур клеток, выделенных у мышей, показали, что LCN2 стимулирует размножение лимфатических эндотелиальных клеток и рост новых лимфатических сосудов. У мышей с раком молочной железы это приводило к образованию метастазов в легких. У генетически модифицированных мышей, чьи клетки были неспособны синтезировать LCN2, подобного эффекта не наблюдалось.
Макрофаги выступают как первая линия иммунной защиты от патогенов: они захватывают и переваривают бактерии, остатки погибших клеток и другие чужеродные частицы. Эти клетки-пожиратели отличаются большим разнообразием и могут изменять свои функции в соответствии с условиями окружающей микросреды. Макрофаги играют ключевую роль в развитии воспалительных реакций, а также поддерживают целостность тканей, участвуя в их заживлении. Этот спектр функций объясняет, почему они оказались тесно связаны со злокачественными опухолями.
Предыдущие исследования продемонстрировали, что макрофаги легко переходят на сторону рака. Опухоль может "рекрутировать" защитные клетки с помощью ряда сигнальных молекул, в результате чего макрофаги начинают подавлять антиопухолевый иммунитет и стимулируют образование новых кровеносных сосудов. Происходит интенсивный процесс ангиогенеза, в результате чего опухоль начинает хорошо кровоснабжаться. Для организма это имеет несколько последствий. Во-первых, опухоль начинает "обкрадывать" здоровые ткани, получая намного больше питательных веществ. Во-вторых, раковые клетки могут метастазировать вдоль стенок кровеносных сосудов или разносятся по всему организму.
Рак, таким образом, можно представить в виде государства, которое не только использует свои собственные ресурсы, но и эксплуатирует свое окружение. Секретируемые им вещества поддерживают микросреду, благоприятную для роста, снабжения и распространения опухоли. Кроме того, здоровые ткани, "присягнувшие на верность" раку, помогают последнему избежать иммунного надзора. Ассоциированные с опухолью макрофаги (АОМ) являются коллаборационистами, выступающими против родного организма. Они в большом количестве встречаются внутри злокачественных новообразований, что обычно связано с плохим прогнозом для пациента.
Было установлено, что опухолевые клетки выпускают такие вещества, как интерлейкин-10 (IL-10), трансформирующий фактор роста бета (TGF-b), простагландин E2 (PGE2) и хемокины. Все эти факторы играют роль в пролиферации (разрастании) тканей, клеточной дифференцировке, воспалительных реакциях и многих других процессах. Однако сигнальные пути, провоцирующие появление АОМ, еще не до конца понятны.
Ученые полагают, что АОМ представляют собой видоизмененные М2-макрофаги, которые участвуют в восстановлении поврежденных тканей. Они поглощают клетки, погибшие в результате апоптоза, и производят противовоспалительные вещества. Клетки, подвергающиеся апоптозу, высвобождают сфингозин-1-фосфат, который координирует деятельность макрофагов. Таким образом, погибающие злокачественные клетки могут использовать те же самые сигнальные пути, чтобы заставить АОМ заняться "регенерацией" окружающих опухоль тканей, что предполагает формирование новых кровеносных и лимфатических сосудов.
Это происходит следующим образом. Во-первых, апоптические раковые клетки выпускают вещества, что подавляют цитотоксичность макрофагов. Во-вторых, если подавить выработку S1P, можно затормозить рост опухолей, ослабить ангиогенез и уменьшить выживаемость раковых клеток. Ученые выяснили, что сфингозин-1-фосфат способствует выработке у иммунных клеток белка LCN2 — молекулы, которая в больших концентрациях присутствует в клетках почек при ишемии или наличии нефротоксических веществ. Было также обнаружено, что LCN2 вызывает пролиферацию эпителиальных тканей. Все это указывает на то, что липокалин-2 действительно поддерживает среду, благоприятную для опухолевого роста и метастазирования.
Такие результаты, по мнению ученых, дают основания полагать, что, если нарушить сигнальное взаимодействие между умирающими опухолевыми клетками и макрофагами, можно предотвратить метастазирование рака.
Александр Еникеев
источник:
Последние материалы раздела
- 30 декабря 2016
Диссертация Мединского как летучий голландец - 30 декабря 2016
Работа есть — денег нет - 29 декабря 2016
"Основной удар придется на московские и петербургские институты" - 29 декабря 2016
Советник Путина: Россию могут отключить от интернета - 28 декабря 2016
Драйверы инноваций
Обсуждение
Добавить комментарий
Обсуждение материалов доступно только после регистрации.